实验室联合中国科学院生物物理研究所等单位以绵羊为模型揭示了反刍动物孕囊延伸与附植的分子调控网络
2023-07-27
反刍动物早期胚胎发育的显著特征是胚胎在附植前会发生快速的孕囊延伸(Conceptus Elongation)过程,最长可达20厘米。这种发育策略可以增加滋养层与子宫内膜的接触面积,弥补胚胎侵入程度的不足。胚胎在此期间经历复杂的细胞命运转变,并分泌干扰素τ(Interferon tau)等多种因子启动妊娠识别和母胎对话。附植失败是早期妊娠丢失的最主要原因之一,反刍动物约70%的胚胎丢失发生在附植前后。因此,解析动物胚胎孕囊延伸和子宫接受态的分子调控,对深入理解动物胚胎发育和研发动物高效繁殖技术均具有重要的意义。
实验室动物繁育与功能基因组学科组联合中国科学院生物物理研究所等单位,以绵羊为模型,构建了孕囊延伸与附植四个关键时期胚胎、胚外组织与子宫内膜组织的单细胞转录组学图谱,系统性梳理了自囊胚孵化至胚胎附着阶段胚胎与胚外组织细胞的快速分化过程,同时详细阐述了子宫内膜不同类型细胞的基因表达水平与分子响应机制。基于该表达图谱,研究团队深入解析了孕囊延伸这一特殊生命事件的启动与维持过程。发现在孵化后囊胚中,极化滋养层细胞的快速增殖首先驱动了孕囊延伸的启动与干扰素τ等关键因子的释放。随后壁层滋养层快速分化为细胞滋养层、合胞体滋养层与绒毛外滋养层,实现了胚外组织结构与不同代谢功能的建立。同时,内胚层谱系细胞也参与了胚外组织的扩张过程,形成包括卵黄囊、尿囊等在内的诸多结构。
同时,子宫内膜细胞也在胚胎的刺激下逐步发生响应性变化。腔上皮细胞免疫功能逐渐下降,发育调控与营养运输功能提升,同时最先实现了与胚胎的接触。在胚胎附着完成前,腺上皮细胞加速实现了纤毛化进程,免疫细胞也实现了细胞类型的重构,为延伸后胚胎的成功附植提供了必要条件。通过对胚胎附植期间母胎界面细胞基因表达与分子互作的全面解析,挖掘了一系列参与胚外组织与子宫内膜间细胞互作的关键调控因子,为深入揭示哺乳动物胚胎发育与母体妊娠识别间的协作关系提供了重要的分子数据集,也为妊娠初期家畜繁殖管理策略的制定与早期妊娠失败预防性药物的研发提供了全新的研究线索。
研究结果以 Single-cell transcriptomic characterization of sheep conceptus elongation and implantation 为题,于7月25日在国际期刊 Cell Reports 正式发表。实验室副研究员贾功雪为论文第一作者,生物物理所研究员马文姬为共同第一作者,实验室研究员杨其恩与生物物理所研究员王晓群为论文通讯作者。该工作得到了中国科学院生态草牧业先导专项(XDA26040302)、国家重点研发计划(2021YFD1200405)和青海省重大科技专项(2021-NK-A5)等项目的支持。贾功雪获得了中国科学院青年创新促进会(2021432)和青海省昆仑英才等人才计划的资助。
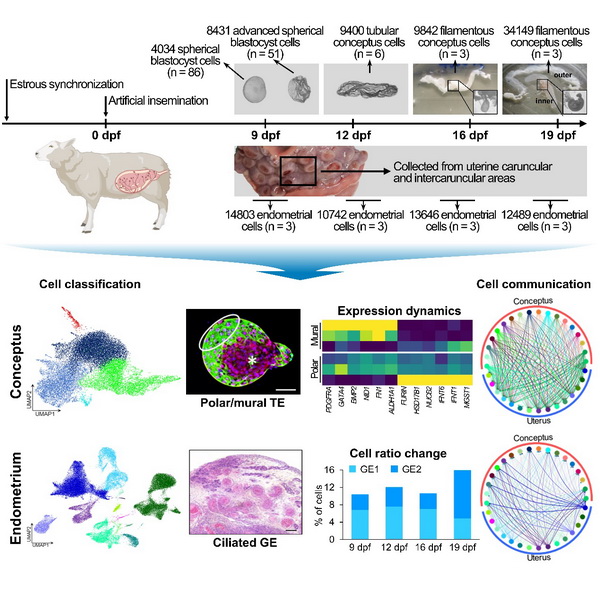
论文模式图:绵羊早期胚胎孕囊延伸与附植过程中的细胞命运转换与基因表达动态



 青公网安备 63010402000197号
青公网安备 63010402000197号